前回の記事では感染症対策の基本について整理しました。
感染症対策としては、基本となる手指衛生や消毒が重要であり、次亜塩素酸ナトリウム(ハイター)は強力な消毒剤として広く活用されています。
今回は、この次亜塩素酸ナトリウムの特性や正しい使い方について化学的特性に着目して解説していきます。
※本記事は、法令やガイドラインに沿って内容・画像の見直しを順次進めています。
一部の図は自作または再構成したものに差し替える予定です。
情報の正確性や最新性を保証するものではありません。
次亜塩素酸ナトリウム
次亜塩素酸ナトリウムとは
次亜塩素酸ナトリウム(NaClO)は、塩素(Cl₂)と水酸化ナトリウム(NaOH)の化学反応によって生成されます。
市販のハイターには約5~6%の次亜塩素酸ナトリウム溶液が含まれており、その殺菌・漂白効果から、家庭でも広く使用されています。
コロナ禍でアルコール消毒液が不足した際には、ハイターを薄めた次亜塩素酸ナトリウム溶液が家庭で使える消毒剤として注目されましたよね。
今の職場でもアルコールの代わりの消毒剤として活用されることが多く、現在もその使用は続けられています。
次亜塩素酸ナトリウムの歴史は古く、1800年代半ばにはその殺菌効果が発見され、利用され始めたそうです。
その効果と利便性から、現在に至るまで殺菌剤として使われ続けています。
化学的特性
強い酸化力
<次亜塩素酸ナトリウム>
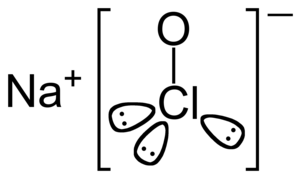
画像引用元:Wikipedia
次亜塩素酸ナトリウムは水溶液中で次亜塩素酸(HOCl)を生成します。
NaClO+H₂O→HOCl+Na⁺+OH⁻
次亜塩素酸ナトリウムの殺菌効果は、HOClの酸化力によるものです。
次亜塩素酸の塩素(Cl)はもともと最外殻に7個の電子を持ち、あと1個で閉殻になるため非常に電子を奪いやすい性質を持っています。
さらに、次亜塩素酸分子内では、Clと結合している酸素(O)側に電子を引き寄せられているため、Clは更なる電子不足状態(Cl⁺)となります。
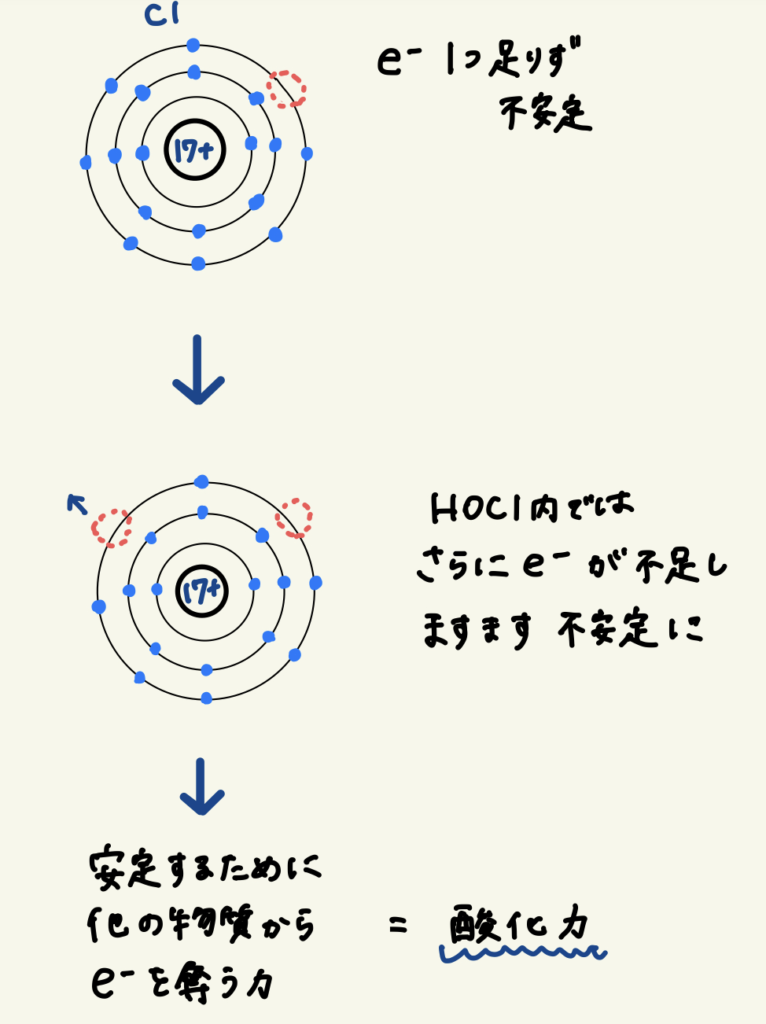
そのため、電子を奪う力=酸化力がさらに強まります。
次亜塩素酸の酸化力についてはこちらの記事でも解説しています。→口腔ケアに効果的な電解水
pHと次亜塩素酸の平衡
次亜塩素酸(HOCl)は弱酸であり、溶液中でその一部が次亜塩素酸イオン(OCl⁻)と水素イオン(H⁺)に電離します。
HOCl ⇄ OCl⁻ + H⁺
この反応は平衡状態にあり、溶液のpHによって反応が左右に傾きます。
アルカリ性の条件下では、溶液中のH⁺濃度が低いため、平衡は右方向に進み、より多くのHOClがOCl⁻とH⁺に電離します。
一方、酸性の条件下ではH⁺濃度が高くなるため、平衡は左方向に進み、OCl⁻がHOClに戻る反応が優先されます。
HOClとOCl⁻は、ともに酸化力を持つため殺菌効果がありますが、HOClの方が殺菌効果が高いことが知られています。
その理由は、HOClが中性分子であり、疎水性の細胞膜を通過しやすいこと、そしてOCl⁻よりも酸化力が強いことにあります。
このため、アルカリ性の条件下ではOCl⁻が多くなり殺菌効果は低下してしまいますが、酸性の条件下ではHOClの割合が増えるため、殺菌効果を発揮しやすくなります。
ただし、強酸である塩酸(HCl)などと混ぜてさらに酸性に傾いてしまうと、HOClは分解され塩素ガス(Cl₂)を発生します。
HOCl+HCl→Cl₂+H₂O
塩素ガスは有毒であるため、次亜塩素酸ナトリウムの製品には「まぜるな危険」という注意表示がされていますよね。
以上の化学的な特性から、殺菌作用を発揮するためには、強い酸化力を持つHOClが変化せずに安定して存在できるpHであることが大切ということがわかります。一般的には、pH 5前後が適切とされています。
殺菌のメカニズム
電子豊富な結合への作用
次亜塩素酸(HOCl)は、病原体に含まれる電子が豊富な結合から電子を奪い、酸化反応を引き起こします。
「電子豊富」とは、分子や結合の中で電子が集中している状態のことで、具体的には以下のような部位が挙げられます。
• 二重結合:二重結合は共有電子が2組あるため、通常の単結合よりもその部分に電子が多く集中しています。
例:オレイン酸-細胞膜のリン脂質に含まれる不飽和脂肪酸の炭素-炭素二重結合(C=C)
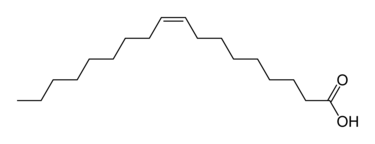
画像引用元:https://ja.wikipedia.org/wiki/%E3%82%AA%E3%83%AC%E3%82%A4%E3%83%B3%E9%85%B8
• 極性のある結合による電子密度の偏り:極性がある結合では、電気陰性度が高い原子が電子を強く引き寄せて電子が偏るため、その部分に電子が豊富になります。
例:システイン-酵素やタンパク質中に存在するアミノ酸のチオール基(-SH)
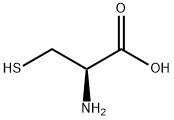
画像引用元:https://m.chemicalbook.com/ChemicalProductProperty_JP_CB7388480.htm
• 孤立電子対を持つ原子:孤立電子対は、原子が共有していない電子対のことで、周囲の結合に使われずそのまま存在しているため、電子が集中しています。
例:グアニン-DNAやRNAを構成する塩基に含まれる孤立電子対
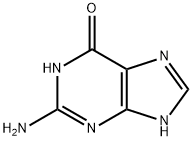
画像引用元:https://m.chemicalbook.com/ChemicalProductProperty_JP_CB3259805.htm
これらの特徴を持つ分子が、次亜塩素酸の酸化反応による攻撃対象となります。
細胞膜の通過・内部への作用
先ほど触れたように、次亜塩素酸(HOCl)は疎水性の細胞膜を通過しやすいという特徴があります。
HOClは中性であるため脂質二重層である細胞膜を通過しやすいのに対し、次亜塩素酸イオン(OCl⁻)は負に帯電して水和イオンとなるため、疎水性の膜を通過できません。
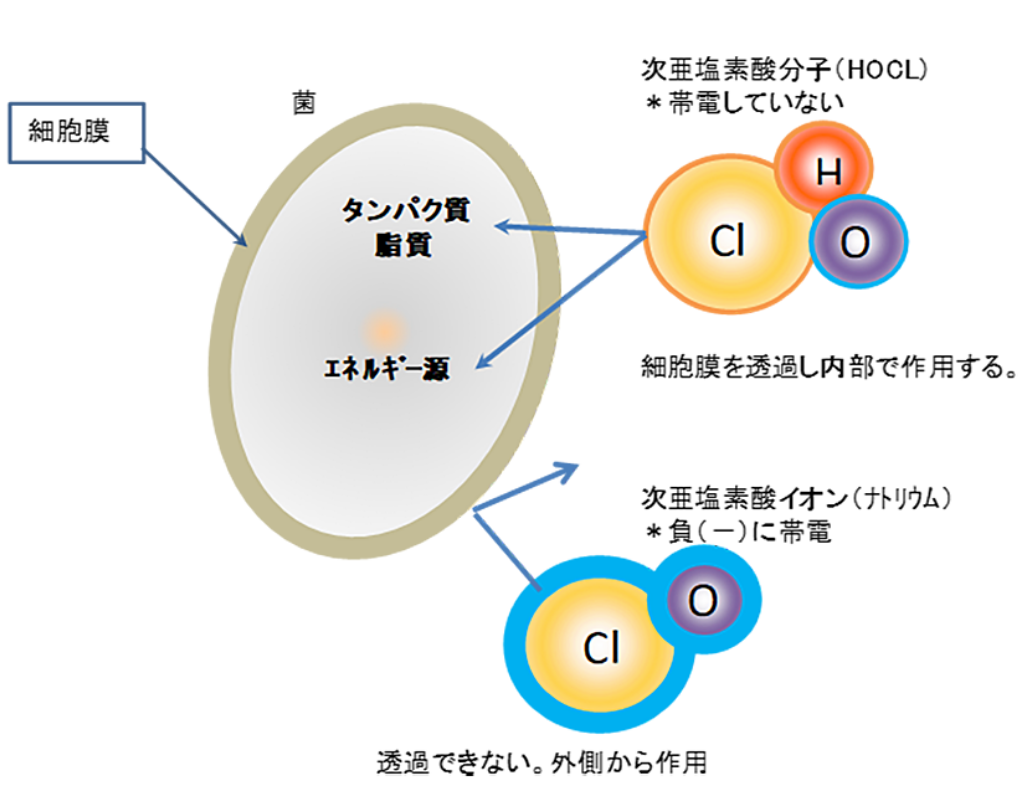
画像引用元:https://gadget-japan.com/brands/montrois/
上のイラストのように、膜を通って病原体の細胞内に侵入したHOClは、先に説明したような酵素タンパク質やDNAの電子豊富な部位を酸化します。
細胞膜を通過し、細胞の中にある細胞活動に必要な酵素や組織を酸化することで、病原体が機能しなくなり、破壊されてしまうということです。
イオンが細胞膜を通過しにくい理由はこちらの記事でも解説しています→インスリンというホルモン
ハイター液の消毒効果がなくなる理由
最後に、今回の研修で聞いた「次亜塩素酸ナトリウムの消毒効果がなくなる理由」について触れておきます。
次亜塩素酸ナトリウム溶液(ハイター液)の消毒効果が低下する主な原因は、手についた有機物(汚れや皮脂など)との反応です。
次亜塩素酸(HOCl)は汚れに含まれる電子豊富な分子と優先的に反応し、酸化力を使い切ってしまうため、病原体への作用が弱まります。
そのため、次亜塩素酸ナトリウムを効果的に使用するには、素手で液に触れないこと、そして物についた汚れをあらかじめ取り除いておくことが大切です。
まとめ
研修をきっかけに、感染症の季節に備えて改めて感染についての知識の確認をしました。
一時期感染対策についての情報に溢れていましたが、感染症対策の基本は、病原体の感染経路を遮断し、適切な手指衛生や消毒を徹底することに尽きます。
今回取り上げた次亜塩素酸ナトリウム(ハイター)は強力な消毒剤ですが、効果を最大限に引き出すには、消毒前の汚れ除去と適切なpHでの使用が重要です。
こうした取り扱いの根拠をもとに、現場に合わせた正しい方法を考えていきたいと思います。
参照
次亜塩素酸による洗浄・殺菌機構と細菌の損傷:https://www.jstage.jst.go.jp/article/jsfm/26/2/26_2_76/_pdf/-char/ja
殺菌・消毒に活躍する次亜塩素酸ナトリウム:http://shokusen.jp/ssk01/wp/wp-content/uploads/2016/07/shokusenkyou_series6.pdf
岡庭豊. 病気がみえる vol.6 免疫・膠原病・感染症. 第2版, メディックメディア, 2022.


