先週は夫の実家に帰省したこともあり、2週間は目標まで勉強時間がとれず、ブログもさぼってしまい反省です。
お盆は普通に仕事で、これで夏休みの家族のイベント的なものも終わったので、今週からはいつものペースに戻し時間を確保できています。
数年ぶりに夫の実家に行って驚いたことは、涼しい地域のはずなのに暑かったことです。
今年の暑さは異常ですよね。
外に出かける時には凍らせたポカリなどを持っていくのですが、
子どもに、
「最後の方は薄くなってまずい。」
と言われました。
確かに、溶けてきたポカリを少しずつ飲んでいると味がどんどん薄くなっていきます。
これは「凝固点降下」という現象に関係しています。
化学で学習した凝固点降下について、子どもにもちゃんと説明すべく、ポカリスエットが凍って溶ける際に何が起こっているのかを詳しく見ていきます。
※本記事は、法令やガイドラインに沿って内容・画像の見直しを順次進めています。
一部の図は自作または再構成したものに差し替える予定です。
情報の正確性や最新性を保証するものではありません。
ポカリスエットの成分と溶液
ポカリスエットは、ただの水ではなく、ブドウ糖やナトリウム、カリウム、クエン酸などが溶け込んだ「水溶液」です。
これらの成分(溶質)が水(溶媒)に均一に分散しています。このように他の物質が溶け込んでいる液体のことを溶液といいます。
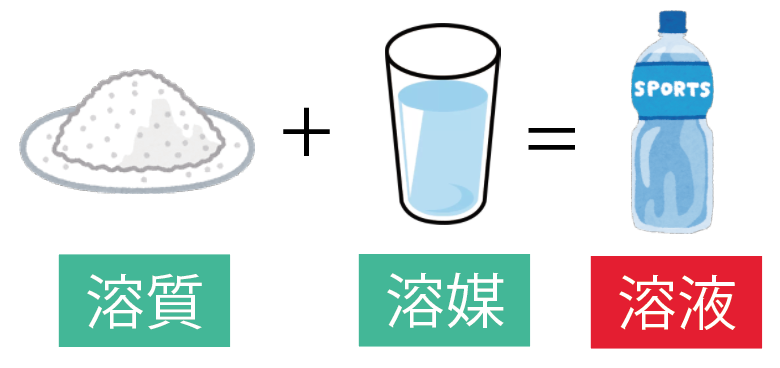
引用元:https://text.tomo.school/solute-solvent-solution/
凝固点降下
凝固点とは
液体が固体に変わる状態変化を「凝固」、固体が液体に変わる状態変化を「融解」といいます。
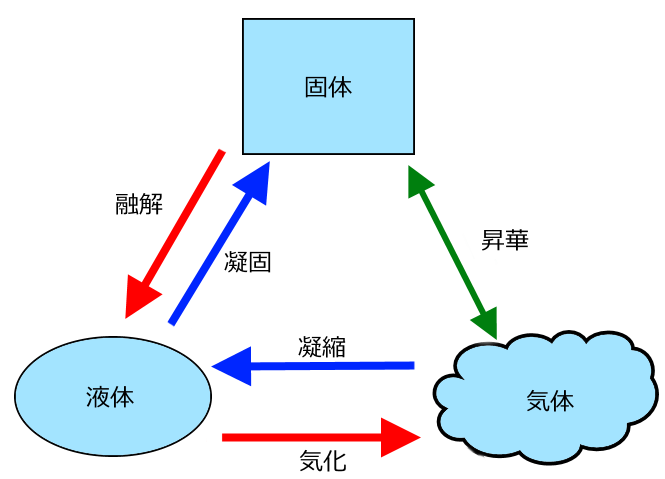
引用元:http://rikamato.com/2017/10/11/1_10/
「凝固点」とは、液体が固体に変わり始める温度のことをいいます。
この凝固点は、物質ごとに異なりますが、純水の場合は0℃です。
凝固点で起きていること
凝固点では、「凝固」と「融解」の速度が釣り合った状態、つまり「固液平衡」にあります。
このとき、凝固が進むとエネルギー(凝固熱)が放出され、逆に融解が進むにはエネルギー(融解熱)を加える必要があります。
固液平衡の状態では、水が凍る速度と、氷が溶ける速度が同じです。
このバランスが取れているため、放出される凝固熱と奪われる融解熱が同じになり、下の図(冷却曲線)のDからEの部分のように温度が一定に保たれます。
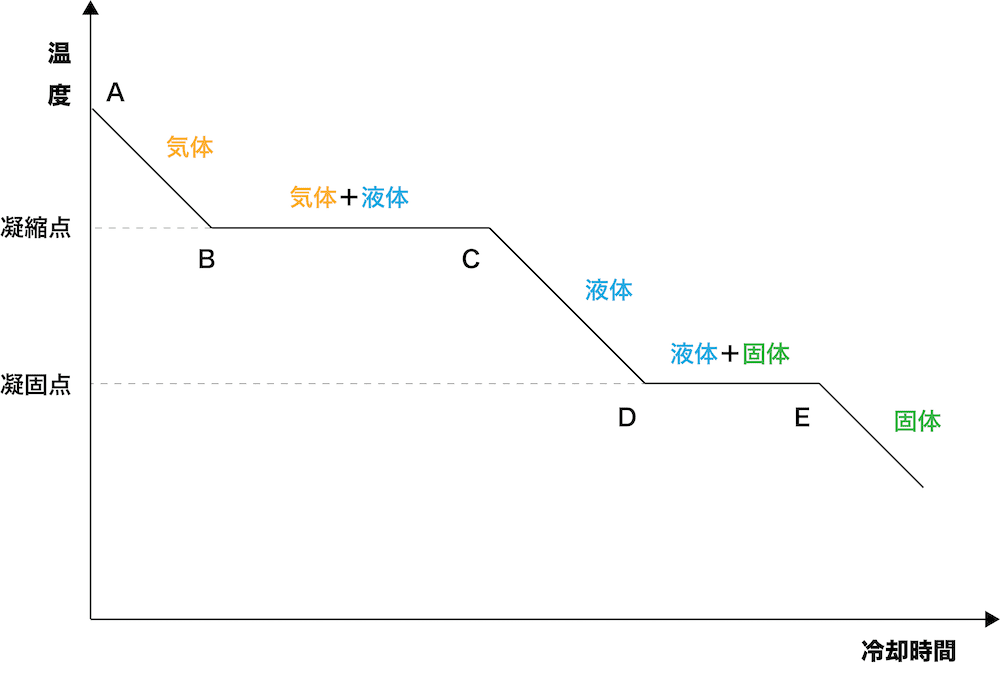
引用元:https://kimika.net/rr4reikyakukyokusen.html
しかし、この凝固の始まりから終わりまで(DからE)の部分を詳しく見ると、下のようになっています。
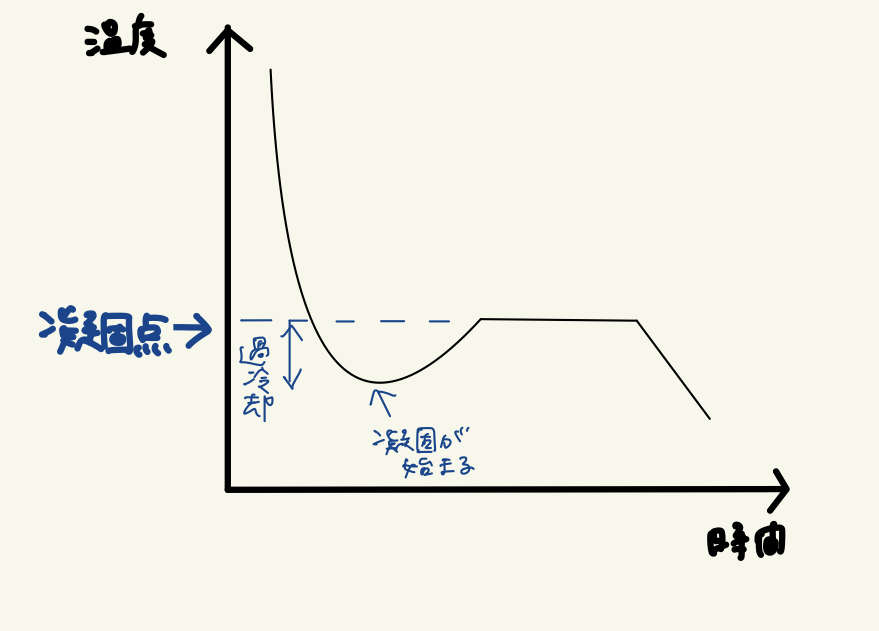
温度が凝固点(0℃)に達してもすぐには一定にならず温度がさらに下がる、過冷却が起きます。
液体の温度が下がり凝固が始まると、凝固熱が発生し、その熱が温度を上昇させ、最終的に凝固点まで戻っているのです。
その後、固液平衡の状態になると、凝固と融解が同じ速度で進み、温度は一定になります。
これが、凝固点で起きているプロセスです。
純水と溶液の凝固点の違い
純水の「凝固点」は通常0℃です。
しかし、溶液の場合、溶質の分子が水分子同士の結合を妨げるため、純水と比べて凍りにくくなります。
このため、凍るスピード(凝固速度)が遅くなり、溶ける方(融解)が優勢になります。
融解時、固まっていた水分子が動き回るようになるためには外からエネルギー(熱)を加える必要があります。
結果として、周囲から熱が吸収されることで温度がさらに低下します。
温度が十分に低下すると、再び凝固と融解が釣り合う「固液平衡」の状態になりますが、その温度は純水の凝固点(0℃)よりも低くなります。
これが「凝固点降下」と呼ばれる現象で、溶液の凝固点が純水よりも低くなる理由です。
さらに、溶液の冷却曲線の凝固の部分を見ると、過冷却が起こり、凝固が始まった後も温度が徐々に下がり続けます。
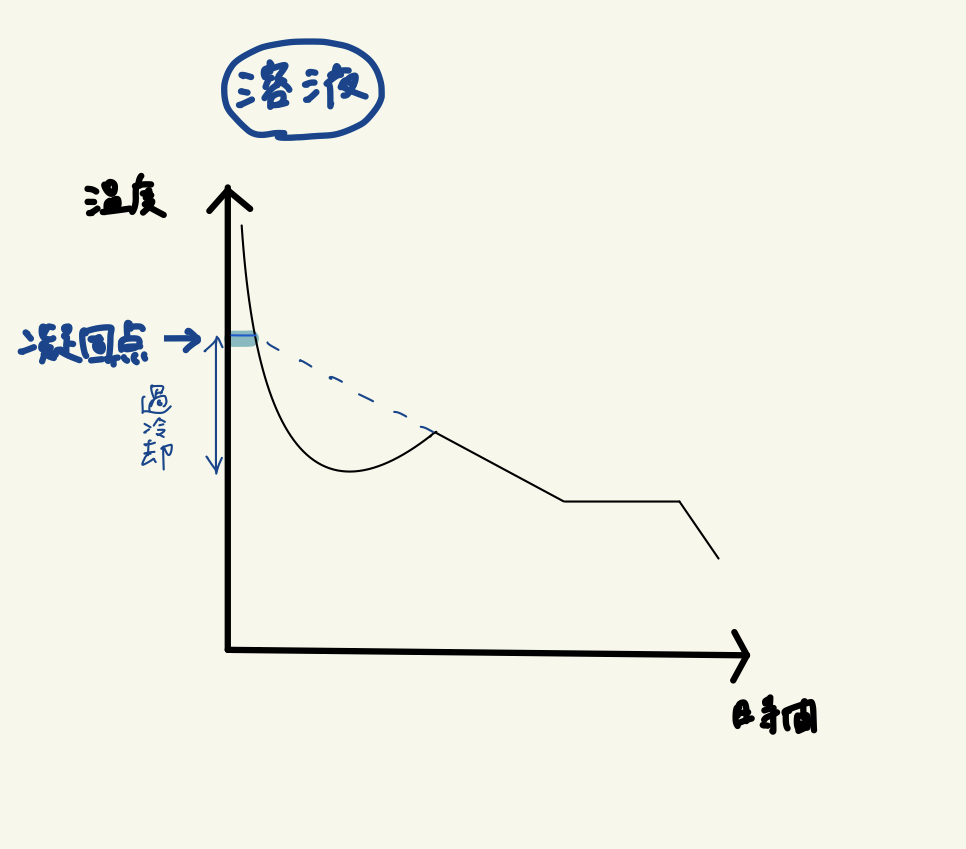
これは、先に溶媒(水)が凍り始めるため、残った液体の濃度は徐々に高くなっていくからです。
溶質の割合が高い液体は、さらに凍りにくなりますよね。
その結果、凝固点がさらに下がっていくため冷却曲線は右下がりになります。
この溶液の凝固点は、右下がりの斜線を左に延長し、グラフと交わった点の温度です。
ポカリスエットが溶ける過程
ポカリが凍るとき、ブドウ糖やナトリウムなどの溶質が存在することで凝固点が低下し、凍る温度が下がります。
同様に、凍らせたポカリが溶ける際にも特有の現象が起こります。
凍ったポカリが溶け始めると、まず溶け出すのは溶質(ブドウ糖やナトリウム)が多く含まれている部分です。
溶質が多い部分は凝固点降下の為、より低温で固まっているので、他の部分よりも低い温度で溶け始めます。
そのため、溶質の多いおいしい部分が先に溶け出して、最後に残る氷は溶質が少なく水分子が多く薄いポカリ味になってしまうのです。
まとめ
凍らせたポカリスエットが溶けるとき、味が薄くなっていくのは、「凝固点降下」という現象によるものです。
水に溶けている溶質の存在によって凝固点が低下することが、溶けて液体になったポカリの濃さの変化につながっています。
今回のような身近な化学現象について、子どもたちが興味を持てるような機会を増やしていきたいと思います。
参照
化学講座第46回:https://www.sidaiigakubu.com/examination-measure/chemistry/46
ポカリスエット公式サイト:https://pocarisweat.jp
卜部吉康(2010) . 『化学の新研究』 . 三省堂 .


コメント