先週は連勤でしたが、仕事の日の3時間、休日5時間の最低ラインの勉強時間の確保はできています。
疲れで体調崩すことが怖かったのですが、2週間位こんなペースで体調変化なく、自信がついてきました。
変わらず化学、内容は電気分解に進んでいます。
電池単元の次にテキストに現れたファラデー定数について、突然公式が並びいまいちよくわからないため、自分の理解のためにまとめていきます。
※本記事は、法令やガイドラインに沿って内容・画像の見直しを順次進めています。
一部の図は自作または再構成したものに差し替える予定です。
情報の正確性や最新性を保証するものではありません。
ファラデー定数の定義
テキストによると「電子1molあたりの電気量の絶対値がファラデー定数」とのこと。
具体的には、1ファラデー(F)は約96485クーロン(C)、つまり、1モルの電子を集めると約96485Cという電気量になるということです。
簡潔な説明でよく分からず、覚えておいてください、と書いてあるので昔の自分だったらとりあえず暗記してしまいそうなこの定義について、順に分解しながら見ていきます。
電気量(C)
C(クーロン)とは電気量を表す単位で、電流(A)×時間(秒)で求められます。
電流を大きくして長い時間流せばたくさんの電気が流れる、というのは想像できるのですが、そもそも電流とは何なのでしょう?
電流とは
今までの学習で、電流とは電子の流れ、と理解していましたが、その定義は以下のように書かれています。
電流は、通常は、電荷群が連続的に動く現象をいう。
Wikipedia
電荷とは
電荷とは、粒子や物体が正か負かどちらかの電気をどれくらい帯びているかを示すもので、物質が持つ基本的な性質の一つです。
ここで原子の構造を確認します。
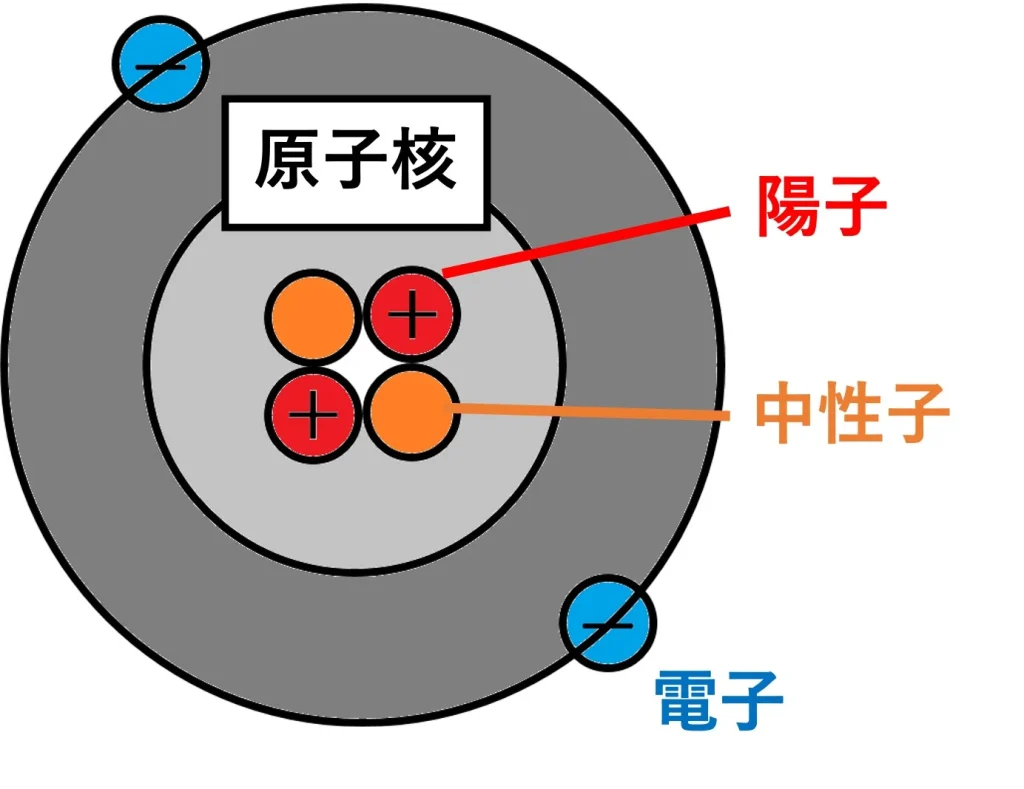
引用:https://school-turnup.com/p-24496/
物質は原子という最小単位からできていて、中心に正の電気を帯びた陽子と、電気的に中性な中性子、その周りに存在する負の電気を帯びた電子からなっています。
原子全体は電気的に中性の状態ですが、電子が移動すると原子が正か負かに偏り、電荷が発生します。
電流は、電荷群、つまり電子や電子の移動により電気を帯びた粒子が流れることで生まれるものなんですね。
電気量と電流の関係
先に述べた、電気量(C)= 電流(A)× 時間(秒)という関係。
これはつまり、導線に1アンペアの電流を1秒間流し、その1秒間分の導線を切り取って、その中に流れる電荷の量が1クーロンと理解できます。
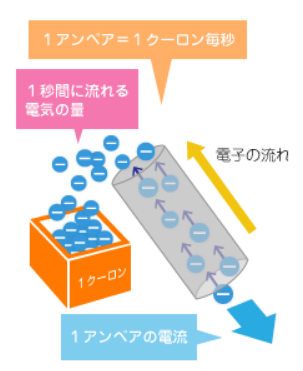
引用:https://www.hochan.jp/knows/electric-2/
電気量(クーロン)は電荷の量で、電荷の偏りの大きさを表しており、この電荷の偏りは、電気エネルギーの大きさに関わっているのではないかと思います。
これで電気量の正体がわかってきました。
クーロン(C)とモル(mol)
電気の力で化学変化を起こすとき、電極で変化するイオンの物質の量は流れた電気量に比例する、つまり、電気量が大きければ、より反応が進むということです。
この化学変化でできた物質の量を知りたい時、物理量である電気量クーロン(C)では計算をすることができません。
なぜなら、化学においては物質の量はモル(mol)で表すからです。
モルとは、小さすぎる原子や分子を数えやすいように、6.022×10²³個分をひとまとまりと考えた物質量の単位です。
そこで使われるのがファラデー定数です。
ファラデー定数は、1モルの電子が持つ電気量を表しているため、この定数を使うことで、電気量(C)を物質量(mol)に変換することができます。
ファラデー定数はどう導びかれたのか
電子の電荷は単純なマイナス1という数字ではなく、実際には昔の実験で -1.602 × 10⁻¹⁹クーロンという値が導き出されています。
この数字から、1モルの電子の電荷量を計算すると、
-1.602×10⁻¹⁹ × 6.022×10²³ =約-96485C
となります。
絶対値とは符号を無視して数の大きさのみを表すため、計算した電子の電気量のマイナスは取り除かれ、96485Cが1F(ファラデー)となります。
あまりわかりやすくはまとまりませんでしたが、自分の中では、冒頭のファラデー定数=電子1モル当たりの電気量という定義の理解が進みました。



コメント